HA/HAP对废水中Cd2+吸附工艺研究
镉(Cd)是一种毒性较大的重金属(Lin et al., 2015), 易被作物和水生生物富集并通过食物链进入人体, 可对人类健康和生态环境造成极大伤害, 因而被广泛关注(Sigdel et al., 2017).目前, 废水中镉的去除方法主要包括吸附法、沉淀法、絮凝法、膜分离法和离子交换法(Al et al., 2017).
羟基磷灰石(HAP)具有成本较低、储存丰富、结构独特和对人体、植物无害等特点, 被研究人员认为是低成本、环境友好的重金属吸附剂(Yang et al., 2016;朱司航等, 2017).但羟基磷灰石会降低土壤有机质含量, 且存在较难从水中去除等问题.为了降低HAP对环境的危害, 同时提高重金属的吸附率, 对HAP进行表面改性是目前的首选(Zhan et al., 2013; Guo et al., 2018; Song et al., 2013).例如, Lei等(2016)通过赤铁矿与十一酸反应使羧基与磁性纳米颗粒表面共价结合, 发现得到的材料具有吸附Cd的显著能力.Guo等(2018)报道了含有凹凸棒石包覆的羟基磷灰石颗粒, 并提高了羟基磷灰石对Cd的去除效率.同样, 氨基功能化材料也表现出从水溶液中去除重金属的优异能力(Guo et al., 2014).由此可以看出, 用于吸附剂表面改性的化合物有一个重要的共同点, 即这些化合物具有较强的金属络合能力.腐植酸(HA)就是这样一种材料, 含很多有机官能团, 包括羧酸、羰基等, 而且反应活性高, 能与环境中的金属发生吸附、络合和氧化还原作用(Hankins et al., 2006).HA与HAP结合不仅改变了HAP的表面性质和环境行为, 而且影响了污染物的吸附效果.之前有研究证明HA与HAP表面有很大的亲和力(Wang et al., 2015).因此, HA修饰的HAP粒子是一种潜在的吸附剂, 可以用于去除水溶液中重金属.
基于此, 本文制备了一种腐殖酸/羟基磷灰石复合材料(HA/HAP), 并利用扫描电子显微镜(SEM)、BET比表面积、傅里叶转换红外光谱(FTIR)、X射线衍射仪(XRD)等手段对HA/HAP进行表征, 同时研究其对Cd2+的吸附性能, 以期为含Cd2+废水的处理提供参考.
2 材料与方法(Materials and methods)
2.1 HA/HAP复合吸附剂的制备
四水硝酸钙和磷酸氢二铵按照物质的量比Ca/P=1.67配置成溶液, 加氨水调节pH值, 搅拌2 h陈化, 烘干得到羟基磷灰石颗粒.取2 g羟基磷灰石颗粒于100 mL、1 g·L-1的腐殖酸溶液, 陈化24 h, 洗至中性.冷冻干燥, 研磨过筛备用.
2.2 实验研究2.2.1 溶液pH值的影响
取500 mg·L-1的Cd2+溶液100 mL于锥形瓶中, 用0.1 mol·L-1 HNO3溶液或0.1 mol·L-1 NaOH溶液调节pH至1、2、3、4、5、6、7, 分别向每个锥形瓶中投加一定量的吸附剂, 室温下振荡240 min, 取上清液利用ICP-AES测定上清液中Cd2+的浓度.进行3组平行实验, 结果取平均值.
2.2.2 吸附剂投加量的影响
取500 mg·L-1的Cd2+溶液100 mL于锥形瓶中, 分别加入0.05、0.1、0.2、0.4、0.6、0.8、1.0 g的HA/HAP和HAP吸附剂, 再用0.1 mol·L-1 HNO3溶液或0.1 mol·L-1 NaOH溶液调节溶液pH至6, 室温下振荡240 min, 取上清液最后用ICP-AES测定上清液中Cd2+的浓度.进行3组平行实验, 结果取平均值.
2.2.3 吸附动力学影响
取500 mg·L-1的Cd2+溶液100 mL于锥形瓶中, 用0.1 mol·L-1 HNO3溶液或0.1 mol·L-1 NaOH溶液调节pH至6, 加入0.8 g HA/HAP吸附剂, 分别在298、308和318 K的条件下振荡1、2、3、5、10、20、30、60、90、120、150、180、210、240 min, 取其上清液, 用ICP-AES测定上清液中Cd2+的浓度.进行3组平行实验, 结果取平均值.
2.2.4 吸附热力学影响
在锥形瓶中分别加入100、200、300、400和500 mg·L-1的Cd2+溶液, 用0.1 mol·L-1 HNO3溶液或0.1 mol·L-1 NaOH溶液调节溶液pH至6, 再加入0.8 g HA/HAP吸附剂, 分别在298、308和318 K的条件下振荡240 min取其上清液, 利用ICP-AES测定上清液中Cd2+的浓度.进行3组平行实验, 结果取平均值.
2.2.5 HA/HAP吸附重金属过程
在无机晶体结构数据库取羟基磷灰石单胞模型作为研究对象, 然后用Materials studio软件CASTEP模块的BFGS算法, 采用GGA-PBE关联函数, OTFG-ultrasoft赝势, 截断能是630 eV, k点设置为1×1×1, 能量收敛标准是5×10-6 eV·atom-1, 原子位移收敛标准是5×10-4 Å, 原子间作用力收敛标准是0.1 eV·nm-1, 晶体内应力收敛标准是0.02 GPa, 自洽场迭代收敛标准是5×10-7 eV·atom-1的参数进行结构优化.
利用Sorption模块中的Locate任务, 采用Metroplise法、Universal力场, 以2×2×2的羟基磷灰石超胞作为吸附剂预测重金属离子在羟基磷灰石上的吸附位, 描述腐殖酸分子与重金属离子的反应过程.
3 结果与讨论(Results and discussion)3.1 HA/HAP复合吸附剂的制备3.1.1 BET法测定比表面积
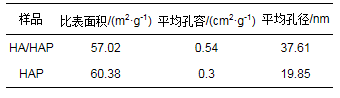
采用氮气吸附脱附法对HA/HAP和HAP比表面积进行分析的结果表 1所示.由表可知, 负载后HA/HAP平均孔径、平均孔容分别为37.61 nm、0.54 cm2·g-1, 较HAP分别提高了90%和80%.由此可见, 增大吸附质离子与吸附剂的接触概率有利于镉离子在吸附剂内部扩散(郭磊, 2014).但负载后HA/HAP比表面积为57.02 m2·g-1, 较HAP降低了5%.主要原因是腐殖酸是有机大分子, 无法进入羟基磷灰石的孔隙当中, 只能包覆在羟基磷灰石外表面(Lei et al., 2016), 表明腐殖酸被成功负载于羟基磷灰石上.此外, HA/HAP和HAP的孔径均在2~50 nm范围内, 孔隙均属于介孔, 而介孔有助于重金属的吸附(Brião et al., 2017).
表 1 HAP和HA/HAP的BET分析
3.1.2 扫描电子显微镜分析
HAP和HA/HAP的形态结构如图 1所示.由图 1a、1b可知, 负载前HAP颗粒团聚现象严重, 孔隙分布不均匀, 颗粒尺寸在5 μm左右, 呈球形, 颗粒之间孔隙明显.图 1c、1d显示负载后HA/HAP颗粒紧实, 形状不规则, 颗粒尺寸在1~90 μm范围.此外, 观察到负载后颗粒表面孔隙数量增加, 孔径变大, 增大了可吸附位点, 有利于重金属的吸附.
图 1

图 1吸附剂扫描电子显微镜图像 (a、b.HAP, c、d.HA/HAP)
3.1.3 傅里叶转换红外光谱分析
HAP和HA/HAP的FTIR对比如图 2a所示.由图可知, 在1088、472 cm-1处分别出现一个显著的伸缩振动吸收峰, 该处峰代表羟基磷灰石中常见的PO43-特征吸收峰(Dong et al., 2016).在630、3203 cm-1处出现来自H2O中O—H伸缩振动峰(庞桂花等, 2013).负载后除1021、560 cm-1两处有明显的吸收峰以外, 在1324、1420 cm-1处出现了两个强烈的特征伸缩振动峰, 由于芳香环C=C的结构振动及COO-中C=O双键的不对称性伸缩振动, 两个C=C、C=O表现出强烈的振动耦合, 会在1420 cm-1附近出现分离的对称伸缩振动和反伸缩振动(Luo et al., 2018), 表明腐殖酸成功负载到羟基磷灰石上.在1324 cm-1处观察到了CO32-的特征峰, 这可能是在制备过程中吸收了空气中的CO2.根据Wang等(2010)的研究, CO32-并不影响HAP的纯度.
图 2
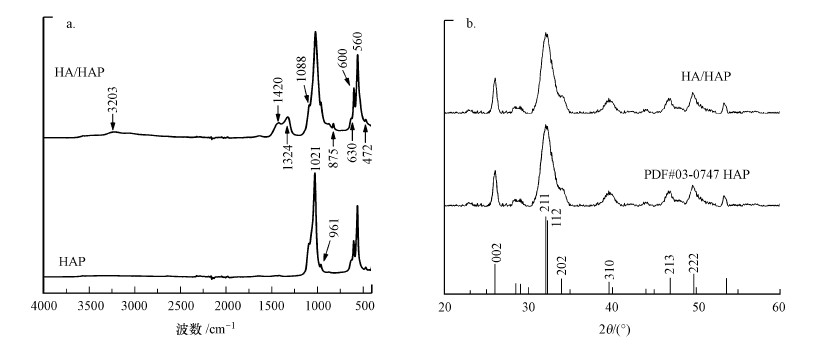
图 2 HAP和HA/HAP的红外光谱(a)和X射线衍射图谱(b)
3.1.4 X射线衍射分析
HAP和HA/HAP的XRD图谱如图 2b所示.可知, 负载前后HAP和HA/HAP的2θ衍射峰25.9°、31.8°、32.2°、33.7°、39.7°、46.7°、49.6°分别对应(002)、(211)、(112)、(202)、(310)、(213)、(222)晶面, 与PDF标准卡片(JCPDS no.0347)相似(Wang et al., 2016), 负载前后无明显差异, 说明HA/HAP中HAP的晶体结构在与HA结合后不仅晶体结构保持不变, 而且提高了重金属的吸附效率(Lei et al., 2016; Wang et al., 2016).
3.2 吸附工艺研究3.2.1 pH值对吸附性能的影响
pH值会影响重金属在溶液中的水解、存在形态和表面电荷等, 这些性质又影响着HA/HAP对Cd2+的吸附过程.pH值对HA/HAP吸附Cd2+的影响如图 3a所示, 可知, 吸附率随pH的增加而增加.在pH=2~3的条件下HA/HAP对Cd2+的吸附能力较低, 主要原因是大量H+与Cd2+竞争活性位点, Cd2+由于静电斥力无法靠近吸附位点.在pH=4~6的条件下H+浓度降低, HA/HAP吸附位点上负电荷增加, 对Cd2+产生引力, 吸附能力提高(Jiang et al., 2012), 在pH=6时吸附率达到最大值98.7%.在pH>6的条件下, 水中OH-增多, Cd2+会生成不溶于水的Cd(OH)2沉淀.考虑到pH>6时Cd2+会水解, 后续实验选择pH=6为最佳条件.
图 3
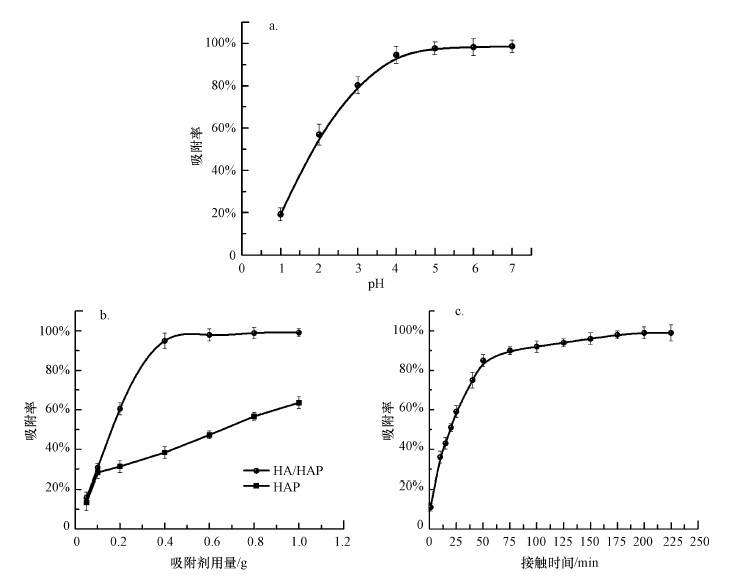
图 3 pH值(a)、吸附剂用量(b)和接触时间(c)对Cd2+吸附效果的影响
3.2.2 投加量对吸附性能的影响
投加量对HA/HAP吸附Cd2+的影响如图 3b所示, 可知, 吸附率随投加量的增加而增加, 当HA/HAP投加量为0.4 g时, Cd2+的去除率增加较快, 原因是HA/HAP活性位点尚未饱和, Cd2+易被HA/HAP内部活性位点吸附, 同时削弱了Cd2+与H+的竞争作用, 并且单位质量的HA/HAP与Cd2+碰撞机会较多(Fukushima et al., 2013).投加量为0.8 g时吸附率为98.87%, 符合要求.此外, 从图 3b中可明显看出, 在任意吸附剂量的情况下, HA/HAP对Cd2+的吸附率均高于羟基磷灰石, 大约是其吸附率的1~2倍, 说明相比于羟基磷灰石, HA/HAP具有更好的吸附Cd2+的能力.
3.2.3 接触时间对吸附性能的影响
接触时间对HA/HAP吸附Cd2+的影响如图 3c所示, 可知, 吸附过程主要由3个阶段构成:快速阶段、慢速阶段和平衡阶段.在0~60 min时, Cd2+的去除率快速增大, 可能是因为初始阶段HA/HAP比表面积比较大, 活性位点较多, 且初始阶段Cd2+浓度较高(陆中桂等, 2018).在60~180 min时, Cd2+的去除率增长缓慢, 这是由于吸附位点逐渐被占据, 当时间达到180 min时, 达到吸附平衡, Cd2+的去除率达到最大值99.02%.
3.3 吸附行为研究3.3.1 吸附动力学研究
准一级动力学假定吸附速率控制步骤是液膜扩散, 其表达式如式(1)所示, 线性表达式见式(2).
![]()
(1)
![]()
(2)
式中, qt是在t时刻的吸附量(mg·g-1);qe是在平衡时刻的吸附量(mg·g-1);k1是准一级模型的速率常数(min-1).
准二级动力学模型假设吸附速率受化学吸附的控制, 化学吸附控制包括吸附剂与吸附质之间电子共用或转移.准二级动力学方程的表达式见式(3), 线性表达式见式(4).
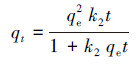
(3)
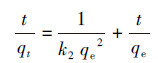
(4)
式中, k2是准二级模型的速率常数(g·mg-1·min-1).
颗粒内扩散模型研究颗粒内扩散是否为吸附速率的限速步骤, 其线性表达式为:
![]()
(5)
式中, kp是颗粒内扩散速率常数(mg·g-1·min-1/2);C是与边界层厚度有关的常数.
HA/HAP吸附Cd2+实验数据如表 2所示, 可知HA/HAP的准一级动力学模型可决系数平均值(0.939)和准二级动力学模型可决系数平均值(0.999)相差不大.将表 2中数据带入颗粒内扩散模型方程并以Qt对t0.5做一条直线, 由于直线不通过原点说明吸附机制伴随着内扩散模型进行.
表 2 HA/HAP对Cd2+吸附动力学参数
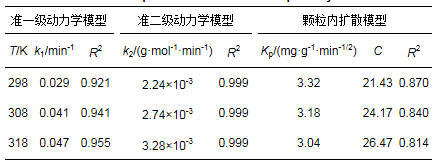
准一级动力学模型常常只是用于吸附初始阶段的动力学描述, 不能准确地描述吸附全过程(Liu et al., 2008).而准二级动力学模型表明吸附由表面反应过程控制, 而非吸附质扩散过程控制.将准一级动力学和准二级动力学数据叠加, 结果如图 4所示.可以发现, 3种温度下两种动力学模型的交点均在120 min附近, 与上述准一级动力学模型更适合描述吸附的初始阶段相一致.因此, HA/HAP吸附Cd2+过程前120 min应用准一级动力学伴随着内扩散模型描述, 120 min后应用准二级动力学伴随着内扩散模型描述.
图 4
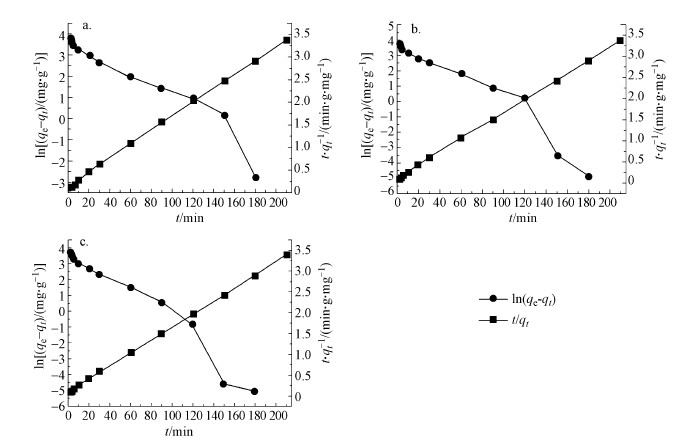
图 4 HA/HAP对Cd2+吸附的准一级动力学和准二级动力学描述 (a.298 K, b.308 K, c.318 K)
3.3.2 吸附热力学研究
吸附热力学计算结果如表 3所示.ΔG0为负值表示HA/HAP吸附Cd2+的过程是自发的, ΔH0为正值表示过程是吸热的, ΔS0为正值表示该过程是可持续的(Cao et al., 2015).
表 3 HA/HAP对Cd2+的吸附热力学参数
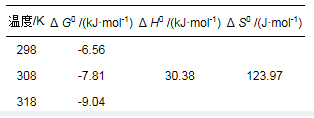
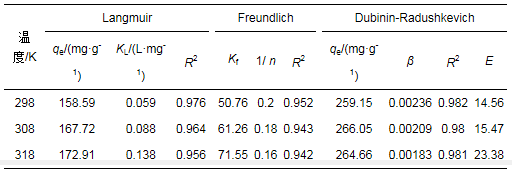
等温线模型参数结果如表 4所示, 可知3种温度下Langmuir模型的可决系数均高于Freundlich模型, 这说明HA/HAP吸附Cd2+主要为单层吸附.随着温度的增大, 单位吸附量增大, 进一步说明HA/HAP吸附Cd2+的过程是自发、吸热、可持续进行的.由Freundlich模型数据可得, 吸附强度1/n值越大, 表明吸附过程中吸附物与吸附剂形成了较强的键(Amir et al., 2016), HA/HAP对Cd2+的吸附作用越强.由Dubinin-Radushkevich模型数据可知E值均大于8 kJ·mol-1, 因此, HA/HAP吸附Cd2+的过程是化学吸附.
表 4 HA/HAP对Cd2+的吸附等温线参数
3.3.3 吸附机理研究
腐殖酸吸附机理:腐殖酸含有羟基、羧基、醇羟基、酚羟基、醌型羰基和酮型羰基等多种活性官能团(孙晓然等, 2015), 这些官能团对羟基磷灰石吸附重金属具有很大帮助.在pH较低时H+与Cd2+存在竞争吸附, 这是因为H+占据了绝大多数的活性位点, 而由于静电斥力原理Cd2+几乎无法靠近吸附位点, 进而抑制了腐殖酸对Cd2+的吸附作用.当5 < pH < 6时, 腐殖酸中的羧基转变为—COO—, 腐殖酸与Cd2+之间由于产生静电引力而使结合能力增强, 吸附量随之增大.
羟基磷灰石吸附机理:应用Materials studio软件结构优化后, 晶格参数a、b值均由9.424变成9.362, c值由6.879变为8.833.羟基磷灰石的晶格参数变化比较明显, 猜测是由于结构不稳定造成的, 相邻两个OH-距离过近, 为了稳定整体结构所以导致两个OH-之间的距离增大.并且由于氢原子核外只有一层电子, 原子核对核外电子的束缚能力强于氧原子对最外层电子的束缚能力, 所以氧原子间的键长增加, c值明显增大.键长增大导致键强减弱, 因此推测Cd2+的吸附位点可能在两个OH-中间.用Sorption模块预测Cd2+在羟基磷灰石晶胞上的吸附位.由图 5可以看出, Cd2+主要吸附在羟基磷灰石晶胞的表面和两个羟基中间, 进而验证了之前的猜想.
图 5
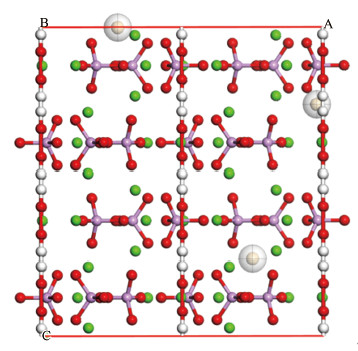
图 5 Cd2+在羟基磷灰石超胞上的吸附位
从图 6可以看出, 价带是由3部分组成:深部价带、中部价带、费米能级附近价带.深部价带能级分布在-40.2~-37.4eV, 贡献较少.中部价带能级分布在-22.4 ~-16 eV, 贡献较多是Ca(Ⅰ) 3p轨道、Ca(Ⅱ) 3p轨道、O(Ⅰ) 2s轨道、O(Ⅱ) 2s轨道、O(Ⅲ) 2s轨道、O(Ⅳ) 2s轨道和H 1s轨道.费米能级附近贡献较多的是O(Ⅰ) 2p轨道、O(Ⅱ) 2p轨道、O(Ⅳ) 2p轨道和H 1s轨道.由此可得出, 羟基磷灰石费米能级附近态密度主要由O(Ⅰ) 2p轨道、O(Ⅱ) 2p轨道、O(Ⅳ) 2p轨道和H 1s轨道构成, 因此, 羟基磷灰石中O(Ⅰ)、O(Ⅱ)、O(Ⅳ)和H具有较高的活性, 也就是说, 羟基磷灰石中的OH-具有较高的活性, 使得羟基磷灰石易与Cd2+发生络合反应, 从而增加了羟基磷灰石的吸附能力.
图 6
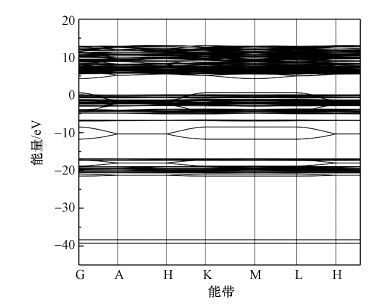
图 6羟基磷灰石的能带结构
从图 7可以看出, 羟基磷灰石的态密度分布在-41.3~15 eV.羟基磷灰石的导带能级分布在3.59~13.5 eV, 包含Ca(Ⅰ) 3s轨道、Ca(Ⅱ) 3s轨道、Ca(Ⅱ) 3d轨道、P 3s轨道、P 3p轨道、O(Ⅰ) 2p轨道、O(Ⅱ) 2p轨道、O(Ⅲ) 2p轨道、O(Ⅳ) 2p轨道和H 1s轨道, 贡献较多的是Ca(Ⅰ) 3d轨道、Ca(Ⅱ) 3d轨道、P 3p轨道和H 1s轨道, 说明羟基磷灰石分子中的Ca2+和H+蕴含的势能较大, 活性较强, 容易与Cd2+发生反应, 从而提高了羟基磷灰石的离子交换能力.将以上结果汇总, 得出腐殖酸负载羟基磷灰石吸附Cd2+的作用过程如图 8所示.
图 7
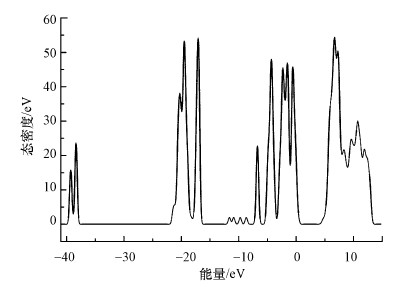
图 7羟基磷灰石的态密度
图 8
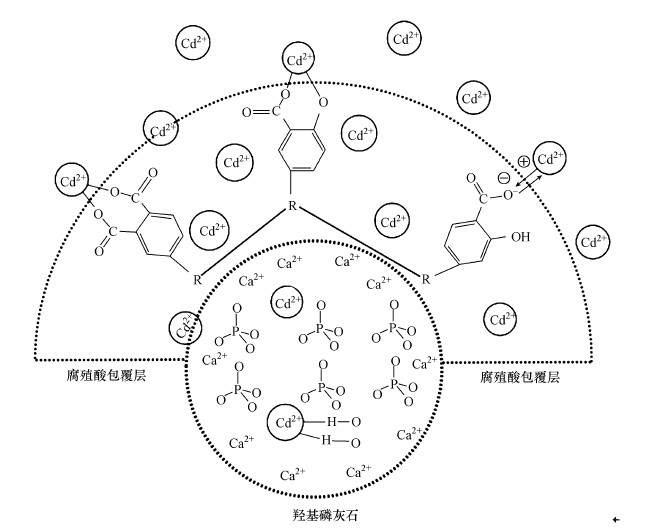
图 8腐殖酸负载羟基磷灰石对重金属离子的吸附机理
4 结论(Conclusions)
1) 表征结果表明, HA/HAP孔隙属于介孔, 羟基磷灰石被腐殖酸修饰后, 孔容和孔径均增大, 比表面积减小, 有助于重金属的吸附.
2) 在对吸附工艺的研究发现, 在酸性条件下HA/HAP对Cd2+的吸附率随pH升高而升高, HA/HAP对Cd2+的吸附效果比HAP好, 并且HA/HAP对Cd2+的吸附率随投加量的增加而增加, 投加量达到0.4 g后趋于平缓, 投加量为0.8 g时吸附率达到最大, 为98.87%.
3) 在吸附行为上的研究发现, 反应时间在120 min之前符合准一级动力学并伴随内扩散动力学模型, 120 min后符合准二级动力学并伴随内扩散动力学模型.热力学参数表明, 吸附过程是自发的、吸热的, 吸附机理为化学吸附类型并且吸附过程中吸附物与吸附剂之间形成了较强的键.
4) 通过构建模型对HA/HAP吸附Cd2+机理研究可知, 容易与Cd2+发生络合反应的是羟基磷灰石中的OH-, 位置大多在表面、两个OH-中间.H+和干扰离子与重金属离子的竞争作用应该是pH较低时重金属离子去除率较低的原因.
广东建树环保科技有限公司是一家专业从事工业废水处理、工业废气处理和环境修复的环保设备研发与销售服务的企业。为工业企业和市政工程等项目提供工业废水处理、工业废气处理、有机废气VOCs处理的一体化解决方案,从“工程设计”、“工程承包”、“设备采购”、“安装调试”、“耗材销售”、“运营管理”、“环评办理”等环节提供专业的差异化服务,联系电话:135 5665 1700。






